introduzione
In chemical kinetics, reaction rate constant , also known as rate constant k Or λ is a quantization representation of the chemical reaction rate.
For the Reactant A and Reactant B to be used as a chemical reaction of produce C , the reaction rate can be expressed This form:
k (t) è la costante di velocità di reazione, che cambierà la variazione di temperatura
[x] is assumed The volume of the substance X is in the case where the substance X is occurred in a fixed volume. (When the reaction occurs in a certain range, it can be expressed in the unit area of X.)
indice m e n sono indicati come il numero di stadi di reazione, a seconda del meccanismo di reazione. Può essere determinato da esperimenti.
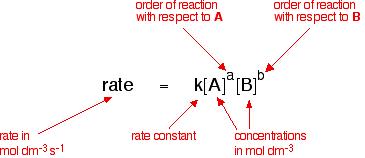
Se una reazione può essere scritta, può anche essere scritta come:
L'equazione di Arnicnis fornisce una base quantitativa per reagire alla relazione tra velocità di reazione ed energia di attivazione.
Velocità di reazione chimica
The reaction rate is , the chemical reaction is slow, the unit is mol / (L · S) or MOL / (L · min) . The reduction in the concentration of the reactants in units of time or the amount of product concentration is increased. The concentration unit generally uses molar · sup> -1 , time units for seconds, minutes or hours. The chemical reaction is not uniformity: the reaction rate is divided into an average rate (average reaction rate at a time interval) and the instantaneous rate (the reaction rate given a given time) can be determined by experiment. The nature of the reactant itself, an external factor: temperature, concentration, pressure, catalyst, light, laser, reactant particle size, contact area and reactant state, X-ray, gamma ray, surface area of X-rays, gamma rays, solid substances, and The contact area of the reactants, the concentration of the reactants can also affect the chemical reaction rate.
collisione
teoria delle collisionei, è del tedesco Max Trautz e del Regno Unito William Lewis nel 1916 e nel 1918 Presentato separatamente.
-
collisionee: si verifica qualsiasi reazione chimica, le particelle di reazione necessarie sono vicine alla collisionee e la velocità di reazione è proporzionale al numero di collisionei.
-
energia di attivazione: la cosiddetta energia di attivazione è l'energia minima che può reagire alle particelle.
-
Collisione effettiva: la cosiddetta collisionee effettiva significa che l'energia della collisionee ha superato l'energia di attivazione e la direzione della collisionee (bit) deve essere corretta (l'energia richiesta per le reazioni chimiche).
Fattori che influenzano la velocità di reazione
Oltre alla natura del reagente, anche la concentrazione, la temperatura e il catalizzatore sono fattori importanti che influenzano la velocità di reazione. La rapida lentezza della reazione del gas è anche correlata alla pressione. Aumentare la concentrazione del reagente, cioè, il numero di molecole attivate nell'unità di volume viene aumentato, aumentando così il numero di collisionei effettive delle molecole del reagente entro l'unità di tempo, con conseguente accelerazione della velocità di reazione. Migliorare la temperatura di reazione, cioè la percentuale di molecole di attivazione, ha anche aumentato il numero di molecole reagenti in unità di tempo, con conseguente accelerazione della velocità di reazione. Utilizzando un catalizzatore positivo, il processo di reazione è stato modificato e l'energia di attivazione richiesta per reagire e la velocità di reazione è stata accelerata. Nella produzione chimica, le condizioni di reazione sono spesso controllate per accelerare la velocità di reazione per aumentare la produzione. A volte è necessario adottare misure per rallentare la velocità di reazione per estendere l'uso dei prodotti.
