Úvod
In chemical kinetics, reaction rate constant , also known as rate constant k Or λ is a quantization representation of the chemical reaction rate.
For the Reactant A and Reactant B to be used as a chemical reaction of produce C , the reaction rate can be expressed This form:
k (t) je konstanta rychlosti reakce, která změní změnu teploty
[x] is assumed The volume of the substance X is in the case where the substance X is occurred in a fixed volume. (When the reaction occurs in a certain range, it can be expressed in the unit area of X.)
index m a n se označují jako počet reakčních stupňů v závislosti na reakčním mechanismu. Lze to určit experimenty.
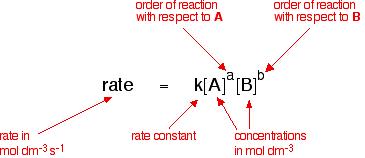
Pokud lze reakci napsat, lze ji také zapsat jako:
Arnicnisova rovnice poskytuje kvantitativní základ pro reakci vztahu mezi reakčními rychlostmi a aktivační energií.
Rychlost chemické reakce
The reaction rate is , the chemical reaction is slow, the unit is mol / (L · S) or MOL / (L · min) . The reduction in the concentration of the reactants in units of time or the amount of product concentration is increased. The concentration unit generally uses molar · sup> -1 , time units for seconds, minutes or hours. The chemical reaction is not uniformity: the reaction rate is divided into an average rate (average reaction rate at a time interval) and the instantaneous rate (the reaction rate given a given time) can be determined by experiment. The nature of the reactant itself, an external factor: temperature, concentration, pressure, catalyst, light, laser, reactant particle size, contact area and reactant state, X-ray, gamma ray, surface area of X-rays, gamma rays, solid substances, and The contact area of the reactants, the concentration of the reactants can also affect the chemical reaction rate.
kolize
kolizní teorie, je od německého Maxe Trautze a britského Williama Lewise v roce 1916 a 1918 předloženo samostatně.
-
kolize: Dochází k jakékoli chemické reakci, potřebné reakční částice jsou blízko srážky a rychlost reakce je úměrná počtu srážek.
-
aktivační energie: tzv. aktivační energie je minimální energie, která může reagovat na částice.
-
Efektivní srážka: Takzvaná efektivní srážka znamená, že energie srážky překročí aktivační energii a směr srážky (bity) by měl být správný (energie potřebná pro chemické reakce).
Faktory ovlivňující rychlost reakce
Kromě povahy reaktantu jsou důležitými faktory ovlivňujícími rychlost reakce také koncentrace, teplota a katalyzátor. S tlakem souvisí také rychlá pomalost reakce plynu. Zvyšte koncentraci reaktantu, to znamená, že se zvýší počet aktivovaných molekul v jednotkovém objemu, čímž se zvýší počet efektivních srážek molekul reaktantu za jednotku času, což má za následek urychlení reakční rychlosti. Zlepšení reakční teploty, to znamená procento aktivačních molekul, také zvýšilo počet molekul reaktantů v jednotkách času, což má za následek zrychlení reakční rychlosti. Použitím pozitivního katalyzátoru se reakční proces změnil a aktivační energie potřebná k reakci a reakční rychlost se zrychlily. V chemické výrobě jsou reakční podmínky často řízeny, aby se urychlila reakční rychlost a zvýšila se produkce. Někdy je nutné podniknout kroky ke zpomalení rychlosti reakce, aby se rozšířilo použití produktů.
