Abriefhistoryofresearch
Inprimitivesociety,primitivepeopleperceivetheexistenceofcarbondioxideintheirdailylife,butduetothelimitationofhistoricalconditions,theylookattheinvisibleandintangiblecarbondioxide.Chengisamonsterthatkillswithoutleavingatrace,notasubstance.
През 3-ти век ДжанХуа (232-300) по време на династията Западна Джин в Китай е записан вид изгаряне на бял камък (CaCO3) Газът, произведен в процеса на производство на бяла пепел (CaO), който вече е газът за печене на вар, използван в индустрията за производството на въглероден диоксид.
Atthebeginningofthe17thcentury,theBelgiandoctorHelmont(ieJanBaptistavanHelmont,JanBaptistavanHelmont,1580-1644)discoveredthatafterburningcharcoal,inadditiontoproducingashesSomeinvisibleandintangiblesubstancesareproduced,andexperimentshaveconfirmedthatthiskindofcarbondioxide,whichhecalledthe"EssenceoftheForest",isanon-combustiblegas,andthatcarbondioxideisagas;itisalsofoundthatcandlesareinthegas.Thisisthefirstdiscoveryoftheinertnatureofcarbondioxide.Soonafter,theGermanchemistHoffmann(ieFriedrichHoffmann,1660-1742)studiedthecarbondioxidegashecalled"spiritusmineralis"andinferredforthefirsttimeThecarbondioxideaqueoussolutionisweaklyacidic.
През 1756 г. британският химик Блек (т.е. Джоузеф Блек, Джоузеф Блек, 1728-1799) е първият, който изследва количествено газта въглероден диоксид, наречен "фиксиран въздух". След това той е наречен "фиксиран въздух" за период от време.
In1766,BritishscientistCavendish(ieHenryCavendish,HenryCavendish,1731-1810)successfullycollectedthe"fixedair"bythemercurytankmethod,andusedphysicalmethodsThespecificgravityandsolubilityweremeasured,anditwasalsoprovedthatitisthesameasthegasexhaledbyanimalsandthegasproducedbyburningcharcoal.
През 1772 г. френският учен Лавоазие (а именно Антоан-Лоран дьо Лавоазие, Антоан-Лоран дьо Лавоазие, 1743-1794) и др. използва голямо пламъчно огледало за кондензиране и нагряване на живак. Пристли, 1733-1804) изучава ферментирал газ, той установява, че налягането е благоприятно за разтварянето на "фиксиран въздух" във вода, и повишаването на температурата не благоприятства разтварянето му..Това откритие позволява въглеродният диоксид да се използва за изкуствено производство на газирана вода (сода).
През 1774 г. шведският химик Бергман (т.е. TorbernOlofBergman, TorbernOlofBergman, 1735-1784) описва в своя вестник "Изследване на неподвижен въздух" Неговите резултати от изследване на плътността на "постоянен въздух", разтворимост във вода, ефект върху лакмус, състояние на абсорбиране от разтвор на алкали, съществуване на алкални разтвори в климата решение.
През 1787 г. Лавоазие описва „фиксирания въздух“, произведен от изгаряне на въглен и кислород, потвърждавайки, че „фиксираният въздух“ е съставен от въглерод и кислород, тъй като е газ и е преименуван на „въглероден диоксид“. В същото време Лавоазие също измерва съотношението на масата на въглерод и кислород (въглеродът се отчита за 23,4503%, оксиген). проследете състава на въглеродния диоксид за първи път.
През 1797 г. британският химик Тенант (т.е. Смитсън Тенант, Смитбсън Тенант, 1761-1815, преведен също „Tainet“ и т.н.) използва аналитичен метод, за да определи, че „фиксираният въздух“ съдържа 27,65% въглерод и 72,35% кислород.
През 1823 г. британският учен Фарадей (т.е. Майкъл Фарадей, Майкъл Фарадей, 1791-1867) открива, че херметизирането може да втечни "карбонов кисел газ". През същата година Фарадей и Дейвид (а именно Хъмфри Дейви, 1778-1829, преведен също като "DiBi") втечняват "карбонов кисел газ" за първи път.
През 1834 или 1835 г. немският тиролец (т.е. Адриан Жан-Пиер Тилорие, Адриан-Жан-Пиер Тилориер, 1790-1844 г. и в превод "Тилорел", "Дилаурияри", "Чилори" и др.) успешно произвежда сух лед (твърд въглероден диоксид).
През 1840 г. френският химик Дюма (а именно Жан-Батист Андре Дюма, Жан-Батист Андре Дюма, 1800-1884) поставя прецизно претеглено съдържание Чистият въглероден графит се изгаря при недостатъчно количество кислород и в резултат на това "фиксиран въздух" се абсорбира от разтвор на калиев хидроксид, а масовата фракция е въглеродна въглеродна маса latedtobe72.734:27.266.По-рано, Авогадро(т.е. АмедеоАвогадро,АмедеоАвогадро,9 август,1776- 9 юли 1856 г.) излага хипотезата през 1811 г. – „При същата температура и под налягане всеки газ с еднакъв обем съдържа един и същ брой молекули.“ Химиците комбинират атомните тегла на кислород и въглерод, за да стигнат до „фиксиран въздух“ на брой кислородни и въглеродни атоми. Простото цяло число е 2:1. Лекулното тегло на „фиксиран въздух“ беше измерено на 44 чрез експерименти, а химическата формула на „фиксиран въздух“ беше CO2, което е същата химична формула. Съответното име е „въглероден диоксид“ .
През 1850 г. ирландският физикохимик Андрюс (тоест Томас Андрюс, Томас Андрюс, 1813-1885) започва да изследва свръхкритичното явление на въглеродния диоксид и през 1869 г. измерва въглеродния диоксид Два критични параметъра: суперкритичното налягане е 7,2 MPa, а свръхкритичната стойност е 7,2 MPa, а свръхкритичната стойност0K5og3 е от двете през 2013 г. бяха съответно 7,375MPa и 303,05K).
In1896,theSwedishchemistArrhenius(SvanteAugustArrhenius,SvanteAugustArrhenius,1859-1927)pointedoutbycalculationthattheatmosphereAdoublingoftheconcentrationofcarbondioxidecanincreasethesurfacetemperatureby5to6°C.
Between1950and1952,theSovietUnion’sLyubavsky(KBЛюбавский),Novorzhlov(HMНовожилов)andJapan’sHarujiroSekiguchieachstudiedtheuseofaprotectivegasforcarbondioxide.Usedweldingwire,andproposedanewmetallurgicalprogramforweldingsteel.Subsequently,in1953,Ljubavskyandothersinventedcarbondioxidegasshieldedwelding.
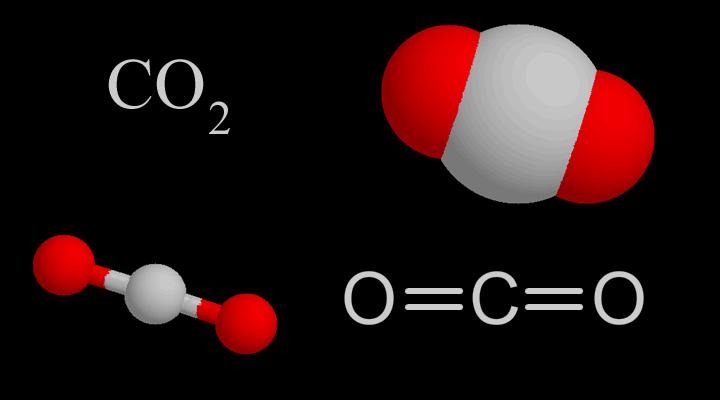
Молекулярна структура
CO₂молекулярна структура | Процес на свързване с CO₂ |
CO2Молекулната форма е права, нейната структура се смяташе за: O=C=O. Но дължината на връзката въглерод-кислород в CO2молекулата е 116pm, което е между двойната връзка въглерод-кислород (дължината на връзката е 124 pm) и тройната връзка въглерод-кислород (дължината на връзката е 113 pm), така че CO2 има определена степен на характеристики на тройна връзка.
ModernscientistsgenerallythinkthatthecentralcarbonatomofCO2moleculeadoptssphybridization,andthetwosphybridorbitalsarerespectivelyconnectedwiththe2porbitalsoftwooxygenatoms(containingoneelectron).)Overlappingtoform2σbonds,theporbitalsperpendiculartoeachotheronthecarbonatomsandtheparallelporbitalsofthe2oxygenatomsrespectivelyform2largeπbonds.
Физични и химични свойства
Физични свойства
Въглеродният диоксид е безцветен и без мирис стайна температура и налягане и е разтворим в повечето органични разтворители като вода и въглеводороди. Физическите константи са както следва:
Точка на топене | 527kPa | Целзий (°C) | -56,6 |
Точка на кипене | Целзий (℃) | -78,5 | |
Относителност | -79 ℃, вода=1 | 1,56 | |
Относителна плътност на изпарението | Въздух=1 | 1,53 | |
Налягане на наситени пари | -39 ℃ | kPa(kPa) | 1013.25 |
Критична температура | Целзий (°C) | 31.3 | |
критично налягане | Мегапаскал (MPa) | 7,39 | |
Коефициент на разпределение октанол/вода | 0,83 | ||
Индекс на пречупване | 12,5~24℃ | 1,173~1,999 | |
моларен индекс на пречупване | 6,98 | ||
Вискозитет | 21 ℃,5,92MPa | mPa·s | 0,0697 |
Топлина на изпарение p> | Сублимация | kJ/mol(kJ/mol) | 25.25 |
Топлопренасяне | kJ/mol(kJ/mol) | 8.33 | |
Генерирайте топлина | kJ/mol(kJ/mol) | 394,40 | |
Специфичен капацитет | 20 ℃, постоянно налягане | kJ/kg·Келвин[kJ/(kg·K)] | 2,8448 |
Налягане на парите | 5,9~14,9℃ | Мегапаскал (MPa) | 4,05~5,07 |
Топлопроводимост | 12~30℃ | Ватсперметър келвин[W/(m·K)] | 0,10048~83,74×10-7 |
коефициент на разширение на тялото | -50~0℃ | перКелвин(K-1) | 0,00495 |
0~20ºC | PerKelvin(K-1) | 0,00991 | |
Молеален обем | Милилитърпермол (mL/mol) | 44.7 | |
Изометричен специфичен обем | 90,2K | 60,9 | |
повърхностно напрежение | Динперсантиметър (дин/см) | 3.4 | |
Степен на поляризация | 10-24cm3 | 2,76 | tr>
(Справка:)
Химични свойства
Въглеродният диоксид е едно от съединенията на въглерода и кислорода. Това е неорганично вещество, незапалимо и обикновено не поддържа горене и не е токсично при ниски концентрации. Също така е киселинен хидрид на въглеродна киселина. Това е киселинен оксид и има същите свойства като анакиселинния оксид. ,въглероден диоксид е оксидиращ и нередукционен, но окисляващ. Не е силен.
1. Общи характеристики на фацидните оксиди
1-1. Реагирайте с вода
Въглеродният диоксид може да се разтваря във вода и да реагира с водата, за да образува въглеродна киселина. Нестабилната въглеродна киселина лесно се разлага във вода и въглероден диоксид. Съответното уравнение на химичната реакция е:
;
.
1-2. Реагирайте с алкаленоксид
При определени условия въглеродният диоксид може да реагира с алкален оксид, за да образува съответните соли, като:
;
.
1-3. Реагирайте с алкали
①иреакция на калциев хидроксид
Addingcarbondioxidetotheclarifiedlimewaterwillmaketheclarifiedlimewaterturbidandformcalciumcarbonateprecipitation(thisreactionOftenusedtotestcarbondioxide),thecorrespondingchemicalreactionequationis:
Когато въглеродният диоксид е прекомерен, се образува калциев бикарбонат:
Първата стъпка:;
Тези втора стъпка:;
Общо уравнение:.
Becauseofthehighsolubilityofcalciumbicarbonate,ifcarbondioxideisaddedtotheturbidlimewaterforalongtime,itcanbefoundthattheprecipitationgraduallydisappears.
②Реакция с натриев хидроксид
Carbondioxidewilldeterioratecausticsoda.Thecorrespondingchemicalreactionequationis:
Когато въглеродният диоксид е прекомерен, се образува натриев бикарбонат:
Първа стъпка:;
Втора стъпка:;
Общо уравнение:.
2.Слабоокисляващ
2-1.Редукция на въглероден елемент
При условия на висока температура въглеродният диоксид може да реагира с въглеродни елементи, за да образува въглероден оксид. Съответното уравнение на химичната реакция е:
.
2-2.Редукция на магнезиев елемент
Условия на недостатъчно осветление, магнезиеви пръчки, може да изгори въглероден диоксид, и съответното уравнение на химичната реакция е:
.
2-3.Редукция на хидрогениране
Въглеродният диоксид и водородът ще възникнат поредица от реакции за генериране на метанол, въглероден оксид и метан. Химичните реакционни уравнения на няколко реакции са:
;
раздел>;
.
2-4. Електрохимична редукция
Електрохимичната редукция на въглероден диоксид е електрическа енергия, редуцира въглеродния диоксид на катода на електролитната клетка и окислява хидроксидни йони до кислород на анода на електролитната клетка. Тъй като редуцирането на въглеродния диоксид изисква висока активираща енергия, този процес може да се осъществи само след приложено високо ниво на напрежение. следователно, ефикасното редуциране на въглероден диоксид изисква подходящ катализатор, така че електрохимичното редуциране на въглероден диоксид да омекоти процеса на електрокаталитична редукция. за да се образува междинен продукт (реакционна формула①); електроните се прехвърлят под действието на потенциалната разлика между двата електрода и броят на прехвърлянията може да бъде 2, 4, 6, 8 ,12.Редукционният продукт може да бъде въглероден монооксид, формиат, мравчена киселина и т.н. в зависимост от броя на прехвърлянията на електрони (реакционна формула②-④).⑵Аноде на електролизна клетка: Реакцията на отделяне на водород протича във водния разтвор за производство на водород (реакционна формула⑤,⑥).
①
②
③
④
⑤
⑥
3. Реагирайте с пероксид
Въглеродният диоксид може да реагира с натриев пероксид (Na2O2), за да образува натриев карбонат (Na2CO3) и кислород (O2),съответното уравнение на химичната реакция е:.
4. Реагирайте с агента Grignard
Underacidicconditions,carbondioxidecanreactwithGrignardreagentinanhydrousethertoformcarboxylicacid,thecorrespondingchemistryThereactionequationis:
Описание: във формулата, ризаналифатна въглеводородна група, ароматна въглеводородна група и ксизахалоген.
5. Реакция на интеркалиране с покси съединения
Carbondioxidecanreactwithepoxycompoundstoformcycliccarbonatesundertheactionofelectrocatalysis,correspondinglyThechemicalreactionequationis:
6. Подготовка на диаманта (реакция на заместване)
При 440 ℃ (713,15 K) и 800 атмосфери (около 808 MPa) при условията на), въглеродният диоксид може да реагира с метален натрий, за да произведе диамант и съответното уравнение на химичната реакция е:.
7.Тъмната реакция на фотосинтеза
Carbondioxideparticipatesinthedarkreactionofphotosynthesisandisanindispensablerawmaterialforphotosynthesisofgreenplants.Theprocessiscalled"carbondioxidefixation",andthecorrespondingchemicalreactionequationis:
Обяснение: C5във формулите е 1,5-рибулозедифосфат, 2C3е 2 молекули на 3-фосфоглицерат.
Waysofproduction
Carbondioxideisapartoftheatmosphere(0.03%-0.04%ofthetotalvolumeoftheatmosphere).Itisabundantinnature.Themainwaysofproductionareasfollows:①Organicmatter(includinganimalsandplants)canreleasecarbondioxideintheprocessofdecomposition,fermentation,decayanddeterioration.②Duringthecombustionofpetroleum,paraffin,coal,andnaturalgas,carbondioxideisalsoreleased.③Petroleumandcoalalsoreleasecarbondioxideduringtheproductionofchemicalproducts.④Allfecesandhumicacidcanalsoreleasecarbondioxideduringfermentationandmaturation.⑤Allanimalsmustbreatheinoxygenandexhalecarbondioxide.
Метод на приготвяне
Индустриална подготовка
Метод на калциниране
Въглеродният диоксид, получен в процеса на калциниране при висока температура на варовик (ордоломит), се измива, отстранява примесите и се компресира, за да се получи въглероден диоксид:
.
Метод за възстановяване на ферментационния газ
Промиване с вода, отстраняване на примеси, компресия, за получаване на въглероден диоксид.
Метод за възстановяване на странични продукти
Ammonia,hydrogen,andsyntheticammoniaareoftenproducedintheproductionprocessTheprocessofdecarburization(removalofcarbondioxideinthegasmixture)allowsthecarbondioxideinthemixedgastobeabsorbedunderpressureandheatedunderreducedpressuretoobtainhigh-puritycarbondioxidegas.
Метод на адсорбционно разширение
Обикновено страничният продукт въглероден диоксид се използва като суровина газ и се използва адсорбционно разширение. Методът извлича въглероден диоксид с висока чистота от фазата на адсорбция и събира продукта с акриогенна помпа; той също може да бъде приготвен чрез метода на адсорбционна ректификация. Може да се приготви след корекция. Продукти от въглероден диоксид с висока чистота.
Метод на пещта на дървени въглища
Рафинира се от газ, получен от въглеродна пещ и крекинг на метанол Получаване на въглероден диоксид.
Получаване от лаборатория
Получаване чрез реакция на мрамор и разредена хлороводородна киселина
Формулата
Thelaboratoryproducescarbondioxide,marbleanddilutehydrochloricacid.Bothtypesofsodaarenotused,andthespeedistoofasttocontrol.
Withoutsulphuricacidhydrochloricacid,magnesiumsaltisnotascheapascalciumsalt.Nitricacidiseasytodecomposewhenexposedtolight.
Реакционни продукти
Мрамор или варовик (основният компонент е CaCO3) и разредена хлороводородна киселина. (Лабораторно производство на въглероден диоксид, мрамор и разредена хлороводородна киселина)
Принцип на реакция
Уравнение на реакцията:<раздел>.
Устройство за подготовка
Тип нормална температура твърдо-течно (на снимката).
Метод на събиране
Becausecarbondioxidehasahigherdensitythanair,itissolubleinwaterandcanreactwithwater,theupwardairexhaustmethodisadopted.
Метод на проверка
Pourthegeneratedgasintoclarifiedlimewater.Thelimewaterbecomesturbid,whichprovesthatthegasiscarbondioxide.
Метод на пълна проверка
Theburningwoodstickisusedatthemouthofthegascylinder(cannotbeinsertedintothebottle).Iftheflamegoesout,itisprovedSetfull.
Предпазни мерки
①Газът от хлороводород (HCl), който може да се изпари по време на реакцията, може да премине през наситен натриев бикарбонат (NaHCO3) Разтворът премахва хлороводорода в генерирания газ.
②Ifnecessary,agasscrubberfilledwithconcentratedsulfuricacidcanbeusedtoremovewatervaporinthegeneratedgas.
③Cannotreactwithcalciumcarbonateandconcentratedhydrochloricacid.Reason:Concentratedhydrochloricacidiseasytovolatilizealargeamountofhydrogenchloridegas,sothatsodiumbicarbonatecannotbecompletelyremoved,andthepurityofthecarbondioxideproducedwilldecrease.
④В лабораторията мраморът (CaCO3) реагира с разредена хлороводородна киселина, за да се получи въглероден диоксид.
⑤Не мога да използвам Na2CO3(сода) и NaHCO3(сода за хляб) вместо CaCO3Той взаимодейства с хлороводородна киселина, за да произведе въглероден диоксид. Причина :Na2CO3и NaHCO3реагират твърде бързо със солна киселина,Произведеният въглероден диоксид излиза бързо,което не е лесно за контролиране и лесно за работа.(Нито един от двата вида газирана вода не се използва и скоростта е бърза за управление)
⑥Разредена сярна киселина не може да се използва вместо солна киселина. Причина: реакцията на разредена сярна киселина с мрамор (CaCO3) ще генерира микро. Утаяването на калциев сулфат (CaSO4), разтворен във вода, покрива повърхността на мрамора, възпрепятствайки протичането на сулфатна реакция (непротичаща.и цидин вместо хлороводородна киселина)
⑦Не може да се използва MgCO3(магнезиева сол) вместо CaCO3(калциева сол), Причина: Въпреки че MgCO3реагира по подобен начин с хлороводородна киселина и CaCO3с хлороводородна киселина, тъй като MgCO3има по-малко източници, не е добър като CaCO3Евтин и лесен за получаване.
⑧Азотната киселина не може да се използва вместо солна киселина. Причина: азотната киселина се разлага лесно, когато е изложена на светлина (). Ако се използва азотна киселина вместо солна киселина, полученият CO ще бъде малко количество NO2и O2в2. Освен това, екск. алино не се използва вместо солна киселина. (Азотната киселина се разгражда лесно, когато е изложена на светлина)
⑨Becausecarbondioxidecanextinguishthefire,aburningmatchcanbeplacedatthemouthofthegascylinderforinspection.Iftheflamegoesout,itprovesthatthegascylinderhasbeenfilledwithcarbondioxide.(Identifythatmatchesarenotcombustible)
Топлинно разлагане на натриев бикарбонат за приготвяне
След като натриевият бикарбонат е напълно изсушен, той се поставя в твърда стъклена тръба и устието на тръбата се пълни със стъклена вата и след това се запечатва и се изтегля вакуум с въздушна помпа. След това нагряването разлага натриевия бикарбонат. Първият въглероден диоксид може да бъде освободен. той се въвежда в U-образни епруветки, съдържащи калциев хлорид и фосфорен пентоксид, за да ги изсушите.
Други методи за приготвяне
Когато сода за хляб (основният компонент е натриев бикарбонат) и бял оцет се смесят заедно, възниква реакция на аметезис и се отделя въглероден диоксид. Съответното уравнение на химичната реакция е:<раздел>.
Mainapplications
High-puritycarbondioxideismainlyusedintheelectronicsindustry,medicalresearchandclinicaldiagnosis,carbondioxidelasers,calibrationgasfortestinginstrumentsandthepreparationofotherspecialmixedgas.Itisusedasaregulatorinthepolymerizationreaction.
Solidcarbondioxideiswidelyusedinrefrigerateddairyproducts,meat,frozenfoodandotherfoodsthatareperishableintransit.Itisusedasarefrigerantinmanyindustrialprocesses,suchascrushingheat-sensitivematerials,rubberpolishing,andmetalColdprocessing,shrinkassemblyofmechanicalparts,vacuumcoldtraps,etc.
Gaseouscarbondioxideisusedforcarbonizationofsoftdrinks,pHcontrolinwatertreatmentprocesses,chemicalprocessing,foodpreservation,inertprotectioninchemistryandfoodprocessing,weldinggas,plantgrowthstimulant,andhardeningincastingMoldsandcoresandusedinpneumaticdevices,andalsousedasadiluentforsterilizinggas(thatis,usingamixtureofethyleneoxideandcarbondioxideasasterilization,insecticide,andfumigant.Itiswidelyusedinmedicalappliances,packagingmaterials,andclothing,Fur,bedding,etc.,sterilizationofbonemeal,fumigationofwarehouses,factories,culturalrelics,books).
Liquidcarbondioxideisusedasarefrigerant,low-temperaturetestsofaircraft,missilesandelectroniccomponents,toimproveoilwellrecovery,rubberpolishingandchemicalreactioncontrol,andcanalsobeusedasafireextinguishingagent.
Свръхкритичният въглероден диоксид може да се използва като разтворител за разтваряне на неполярни, нейонни съединения и съединения с ниско молекулно тегло, така че се използва широко в хомогенни реакции.
Изчисляване на химични данни
Изчислителна референтна стойност на хидрофобен параметър (XlogP) | 0,9 |
Брой акцептори на водородни връзки | 2 |
Топологична молекулярна полярна повърхност | 34.1 |
Брой тежки атоми | 3 |
Сложност | 18.3 |
Брой единици на ковалентната връзка | 1 |
(Tablereference:)
Мерки за безопасност
Аспекти на природната среда
Опасности за околната среда
Естествен парников ефект: парникови газове като въглероден двуокис в атмосферата могат силно да абсорбират дълговълнова радиация от земята. Дълга вълна радиация с по-дълга дължина на вълната се излъчва към земята, което играе роля на изолация на земята.
Enhancedgreenhouseeffect:SincetheIndustrialRevolution,humanactivitieshaveemittedalargeamountofgreenhousegasessuchascarbondioxide,whichhascausedtheconcentrationofgreenhousegasesintheatmospheretorisesharply,resultinginanincreasinggreenhouseeffect.Accordingtostatistics,beforeindustrialization,theglobalaverageannualatmosphericcarbondioxideconcentrationwas278ppm(1ppmisonepartpermillion).In2012,theglobalaverageannualatmosphericcarbondioxideconcentrationwas393.1ppm.ByApril2014,themonthlyaveragecarbondioxideconcentrationintheatmosphereofthenorthernhemisphereItexceeded400ppmforthefirsttime.
Globalwarming:Theincreasinggreenhouseeffectoftheatmospherehasledtoglobalwarming,resultinginaseriesofglobalclimateproblemsthatareunpredictablebysciencetoday.AccordingtotheInternationalEconomicsofClimateChangeReport,ifhumanbeingscontinuetomaintaintheircurrentlifestyles,by2100,thereisa50%chancethattheglobalaveragetemperaturewillriseby4°C.Iftheglobaltemperaturerisesby4℃,theglaciersinthenorthandsouthpolesoftheearthwillmelt,andthesealevelwillriseasaresult.Morethan40islandcountriesandthemostpopulouscoastalcitiesintheworldwillbeindangerofbeingsubmerged,withtensofmillionsofpeopleworldwide.Hislifewillfaceacrisis,andevenaglobalecologicalbalancedisorderwilleventuallyleadtolarge-scalemigrationandconflictsaroundtheworld.
Мерки за противодействие
Живот с ниски въглеродни емисии: Минимизиране на потреблението на енергия в ежедневния живот, като по този начин се намаляват емисиите на въглероден двуокис, намалява се замърсяването на въздуха и се забавя екологичната деградация.
CCStechnology:carbondioxidecaptureandstorage(CarbonDioxideCaptureandStorage,abbreviation:CCS)technology,isoneofthemostimportanttechnologiestodealwithglobalclimatechangeintheshortterm,referringtotheuseofcarboncapturetechnology,Separatethecarbondioxideproducedbyindustryandrelatedenergyindustries,andthentransportandsealittotheseabedorunderground,etc.,whichisisolatedfromtheatmosphere,throughstoragemeans.
Internationallaw:AttheUnitedNationsConferenceonEnvironmentandDevelopmentheldinBrazilinJune1992,153countriessignedtheUnitedNationsFrameworkConventiononClimateChange.ThisconventionhasbeeneffectivesinceMarch1994.Thereare176contractingparties(asofFebruary2015);InDecember1997,ameetingattendedbyparticipatingcountriesofthe"JointFrameworkConventiononClimateChange"washeldinKyoto,Japan.Themeetingformulatedthe"KyotoProtocol"asthe"JointFrameworkConventiononClimateChange".AsupplementaryclausetotheFrameworkConventiononChange.ThistreatyhasbeeneffectivesinceFebruary16,2005,andhas183contractingparties(asofFebruary2009);November30-December11,2015,heldinParisAtthe21stConferenceofthePartiestothe"JointFrameworkConventiononClimateChange"andthe11thConferenceofthePartiestothe"KyotoProtocol",representativesfrom195countriesunanimouslyadoptedthe"ParisAgreementoftheUnitedNationsFrameworkConventiononClimateChange"("ParisAgreement").
Intermsofhumanhealth
Researchshowsthatwhentheconcentrationofcarbondioxideintheairislessthan2%,thereisnoobviousharmtohumans.Iftheconcentrationexceedsthisconcentration,itcancausedamagetothehumanrespiratoryorgans.Undercircumstances,carbondioxideisnotatoxicsubstance,butwhentheconcentrationofcarbondioxideintheairexceedsacertainlimit,thebodywillbepoisoned,andhighconcentrationsofcarbondioxidewillsuffocatepeople.Animalexperimentshaveprovedthat:intheairwithnormaloxygencontent(20%),thehighertheconcentrationofcarbondioxide,thehigherthemortalityofanimals.Atthesametime,purecarbondioxidecausesanimaldeathsanddeathscausedbyloweroxygenaremorerapid.Inaddition,somepeoplebelievethatinthecaseoflowoxygen,carbondioxideataconcentrationof8%to10%cancausedeathsofhumansandanimalsinashortperiodoftime.
Принцип на отравяне
High-concentrationcarbondioxideitselfhasstimulatingandanestheticeffectsandcancausehypoxiaandasphyxiationinthebody.
Симптоми на отравяне
Леко: Общ дискомфорт, като замаяност, главоболие, мускулна слабост и болки в тялото.
Умерено: световъртеж може да падне на земята; стягане в гърдите, непоносима болка в носната кухина и гърлото, недостиг на въздух, натиск и задушаване в гърдите; силно главоболие, шум в ушите, мускулна слабост, зачервена кожа, повишаване на кръвното налягане, пулсът е силен.
Тежко: внезапно замаяност и невъзможност за опора, падане на земята, задържане на дъха, диспнея, сърцебиене, безсъзнание, кома, натъртвания по кожата, устни и нокти, спадане на кръвното налягане, слаб пулс и разширени зеници. загубата може да остане след острия период.
Първи мерки
①Quicklygetthepoisonedpersonoutofthehigh-concentrationcarbondioxideenvironment,gotothefreshair,loosenthepoisonedperson’scollar,artificialassistanceBreatheinordertobreatheinoxygenassoonaspossible,andtreatwithhyperbaricoxygenifnecessary.Rescuersshouldweareffectiverespiratoryprotectiveequipment.
②Injectrespiratorystimulants,andantibioticsforsecondaryinfections;intravenousinfusionofsodiumbicarbonateorsodiumlactateforreducedcarbondioxidebindingcapacity;largerdosesofsedativesforlimbspasm;long-termhighfeverandconvulsionsSedativedrugscanbeused;othersymptomatictreatmentssuchaspulmonaryedemaandcerebraledema.
Предпазни мерки
Beforeenteringaworkareawithahigherconcentrationofcarbondioxide,checkwhethertheconcentrationofcarbondioxideintheairexceeds2%.Ifitexceeds,youneedtoTakeeffectivesafetymeasures,suchas:①Ventilationanddetoxification,replacingtheairintheworkplace,sothattheconcentrationofcarbondioxideintheairdoesnotexceed2%;②Wearingventilationmasks,self-primingductgasmasks,oxygenbreathingapparatusandothercommonlyusedanti-virusmask.
Storageprecautions
Carbondioxideissuitableforstorageinacool,ventilatednon-combustiblegaswarehouse,suitableforshipmentinliquidorsolidform.Payattentiontothefollowingpointswhenstoringandtransportingcarbondioxide:①Keepawayfromfireandheatsources,andthestoragetemperatureshouldnotexceed30℃;②Storeseparatelyfromeasily(combustible)materialsandavoidmixedstorage;③Thestorageareashouldbeequippedwithleakageemergencytreatmentequipment.
Съответни закони и наредби
В Китай въглеродният диоксид е пуснат на 12 април 2007 г. и въведен на 1 ноември 2007 г. Част 1: Граници на професионална експозиция за опасни фактори на работното място: За 90-то вещество в „Химически вредни фактори“ (GBZ2.1-2-преки хигиенни изисквания007), среднопретеглената по време (PC-TWA) на работното място е 9000 mg/m3, Допустимата концентрация-Граница за краткотрайна експозиция (PC-STEL) е 18000mg/m3. В допълнение, националната наредба, тясно свързана с въглеродния диоксид, е националният стандарт "Метод за определяне на въглероден диоксид във въздуха на обществени места" (GB/T18204.24-2000), който определя метода за определяне на концентрацията на въглероден диоксид този стандарт е одобрен през септември 2014 г. :ChemicalPollutants"(GB/T18204.2-2014)издаден на 3 декември 2014 г. и въведен на 1 декември 2014 г. За откриване на въглероден двуокис, стандартните методи за откриване, препоръчани от "Методи за санитарна инспекция на обществени места, част 2: Химични замърсители" включват 3 метода за откриване на мими-газ, а именно червен спектрален (не концентрацията е 0,01%) и метод на газова хроматография (най-ниската откриваема концентрация е 0,014%), метод на обемно титруване ( най-ниската откриваема концентрация е 0,001%).
В Съединените щати Американската конференция на правителствените промишлени хигиенисти (ACGIH) прагова концентрация, Администрацията по безопасност и здраве при работа (Occupational Safety and HealthAdministration, OSHA) допустими стойности на концентрацияи препоръчителната стойност на концентрация на Националния институт за безопасност и здраве при работа (5<000sup(NIOSH) >-6).
